Besi (Fe) dan Belerang (S) akan membentuk senyawa FeS (besisulfida). Antara besi dengan besisulfit terbentuk eutektikum pada kandungan S 30,5% serta temperatur 985 oC. Besi δ pada temperatur 1365 oC, mampu melarutkan S sebesar 0,17%, sedangkan besi γ sebesar 0,07%. Masih dipertanyakan apakah besi α juga mampu melarutkan unsur S ini. Yang pasti adalah bahwa besi α memiliki kemampuan yang sangat rendah dalam melarutkan S.
 Gambar 1. Diagram Biner Fe – S.
Gambar 1. Diagram Biner Fe – S.
Namun demikian, berbeda dengan unsur-unsur pendamping besi lainnya, walaupun S pada kandungan yang sangat sedikit justru akan membetuk fasa-fasa dengan karakteristik tertentu dalam ikiatannya dengan unsur Si, Mn dan P disamping senyawa FeS. Fasa-fasa ini berupa bercak-bercak kotoran non logam yang telah dapat dikenali pada sampel poles yang belum dietsa.
Berdasarkan diagram biner Fe–S seharusnya pada kandungan S yang rendah, eutektikum Fe + FeS yang memiliki titik cair rendah sudah akan ditemukan pada batas-batas butiran kristal besi. Namun, karena terjadi penguraian eutektikum, hal tersebut tidak terjadi. Besi yang terdapat didalam eutektikum terkristalisasi pada kristal-kristal besi primer, sedangkan besi sulfida yang tertinggal kemudian terbentuk sebagai lapisan-lapisan yang agak tebal pada batas-batas butiran.
 Gambar 2. Besisulfida pada batas butiran kristal besi. (Non etsa)
Gambar 2. Besisulfida pada batas butiran kristal besi. (Non etsa)
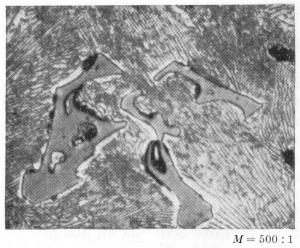 Gambar 3. Mangansulfida (MnS) pada baja cor
Gambar 3. Mangansulfida (MnS) pada baja cor
Hal ini mengakibatkan besi pada temperatur tempa menjadi rapuh, sehingga menurun kemampuan tempanya. Hal ini disebabkan karena fasa yang memiliki titik lebur rendah dan terdapat pada batas-batas butiran akan segera mencair, sehingga antara setiap butiran kristal tidak terdapat lagi kristal-kristal padat yang menjadi media ikatannya.
Sebagian besar baja hanya memiliki kandungan S sangat rendah. Maksimum sampai 0,06%. Walaupun pada temperatur 985 oC belum terdapat eutektikum (Fe–FeS) cair, namun bahaya terjadinya kerapuhan tetap harus diwaspadai, terutama bila baja hanya mengandung unsur Mn yang sangat rendah.
Unsur Mn dalam baja dapat mengurangi risiko terjadinya perapuhan panas, karena Mn akan bersenyawa dengan S menjadi mangansulfida (MnS) yang memiliki titik lebur 1610 oC dan terbentuk primer bahkan pada baja cair. Dibawah mikroskop MnS tampak sebagai pulau-pulau berwarna biru kelabu (gambar 15) diantara matriks baja. Bentuk-bentuk seperti ini merupakan bentuk khas dari kristal-kristal yang terbentuk secara primer, dimana pembentukannya dipengaruhi oleh tegangan permukaan cairan. MnS ini tersebar didalam struktur baja dan juga besi cor tanpa memberikan pengaruh terhadap sifat-sifat mekaniknya.
Berbeda dengan pada umumnya pengotor non logam didalam baja, seperti silikat dan alumina, maka sulfida baik pada waktu dingin maupun panas, memiliki plastisitas yang baik. Sulfida-sulfida ini tidak menjadi hancur akibat deformasi plastis terhadap material, namun akan menjadi pipih dan memanjang serta akan kembeli kebentuk-bentuk bulat setelah baja mengalami proses pemanasan yang disertai pendinginan sangat lambat.
Belerang (S) sebagaimana fosfor (P) memiliki kecenderungan untuk segregasi sebagai segregasi blok maupun gas. Hal ini akan terjadi terutama apabila proses peleburan khususnya baja dilakukan secara tidak cermat serta terjadi banyak sekali gejolak. Dengan demikian unsur ini juga dimasukan dalam golongan unsur yang tidak dikehendaki. Mn (0,5% – 0,9%) merupakan unsur yang ditambahkan untuk mencegah efek buruk yang disebabkan oleh S.
salam foundry pak,
sy mau bertanya, jika sy menginginkan FeS sebagai bahan penambah, ada tidak spesifikasi kimianya pak?range unsur-unsurnya?sebagai spesifikasi enjiniring utk pembelian FeS.nuhun
Yth mas Stefanus.
Besi sulfide merupakan senyawa (bukan paduan) dengan rumus Iron disulfide= FeS2 ataupun Iron sulfide (Iron(II) sulfide)= FeS. Memiliki densitas (bulk) 22-2.5 (g/cm3). Titik lebur 1193 oC. Pada umumnya berbentuk Kristal sulfide yang memiliki kilau dan agak sulit untuk dilarutkan dalam air. Kandungan S dalam FeS berkisar antara 48-50%. FeS berupa serbuk abu2, dapat membeli ditoko2 kimia. Biasanya sudah dalam kemasan.
FeS jarang digunakan pada proses peleburan, karena S pada umumnya merupakan unsur yang dihindari.
Semoga membantu.
Bahan/unsur apa saja yang bisa mengurangi kandungan sulfur yang ada pada besi beton (masih dlm bentuk cairan) …?
Yth mas Isa
Desulfurisasi cairan baja dapat dilakukan dengan menambahkan bahan pereaksi (melalui injeksi atau pencampuran), seperti kapur (CaCO3), kalsium karbida (CaC2) dan magnesium (Mg). Kapur (lime stone) merupakan bahan pereaksi yang paling banyak diterapkan, digunakan dalam setiap proses desulfurisasi baik proses BF hingga SM. Kapur bereaksi dengan sulfur terlarut melalui reaksi berikut:
CaCO3 –> CaO + CO2
2CaO + 2S –> 2CaS + O2
Semoga membantu.
selamat siang.pak widodo saya ingin bertanya: Apakah chiler itu ada usia pemakaiannya.jika terlewat usianya apakah bisa mempengaruhi benda kerja atau produk.terima kasih
selamat siang.pak widodo saya ingin bertanya: Apakah chiler itu ada usia pemakaiannya.jika terlewat usianya apakah bisa mempengaruhi benda kerja atau produk.terima kasih
FeS itu paramagneetik atau diamagnetik
Mau tanya pak..bagai mana cara menghilangkan unsur S.dalam calcopyrite.apakah menggunakan cupola bisa di dapat logam tembaga dari material calcopyrite tsbt.. Dan fluks apa yang di gunakan
Yth mas Triono
Blastfurnace, semacam kupola, digunakan untuk memanaskan ore (calcopyrite/CuFeS2) bersama Silika dan Kalsiumkarbonat (batu kapur) serta hembusan O2 (udara), shingga terjadi reaksi2 sbb:
1. Calcopyrite terurai menjadi tembaga sulfida (CuS) yang nantinya akan terurai lagi menjadi Cu dan SO2.
2. Besi dan silka akan bersenyawa menjadi Besisilikat (FeSiO3) dan keluar sebagai terak bersama dengan kalsiumkarbonat.
3. Sebagian besar belerang (S) sudah akan menjadi gas buang SO2. (Biasanya ditangkap untuk dijadikan bahan baku produksi asam sulfat)
Reaksinya:
2CuFeS2 + 2SiO2 + 4O2 —> Cu2S + 2FeSiO3 + 3SO2
Cu2S + O2 —> 2Cu + SO2
Produk akhirnya disebut Blister Copper yang keropos dan rapuh, dengan kandungan Cu 98-99.5%.
Semoga membantu.
Mau nanya juga nih pak, kenapa sih pak Fe bisa mengikat S tetapi H2 nya lepas?
mau tanya pak, cara melarutkan FeS2 yg mengeras di tabung reaksi bagaimana ya pak ?
Yth mBak/mas Ruri
Bukankan Pyrite larut dalam asam…?
Semoga membantu.
Mau tanya apakah besi tergabung dengan belerang melaui reaksi kimia dengan perbandingan tertentu yg tepat?
Yth mBak Wulan.
Besi (Fe) dan belerang (S) akan membentuk senyawa FeS. Berdasarkan berat atom masing2, maka akan terbentuk senyawa dengan perbandingan Fe : S = 7 : 4.
Semoga membantu.
mau tannya pak
apa pengaru sulfur di dlm baja?
Yth mas Juanda.
Sulfur (S) biasanya dianggap sebagai pengotor dan memiliki efek buruk terhadap sifat impak pada baja dengan kandungan sulphur tinggi yang disertai mangan rendah. Sulfur meningkatkan machinability namun menurunkan transverse ductility dan notched impact toughness. Namun demikian ia begitu berpengaruh terhadap longitudinal mechanical properties.
Dalam baja pada umumnya, kandungan S dibatasi hingga 0,05%. Tetapi pada free cutting steel ditambahkan hingga 0,35% namun disertai dengan penambahan kandungan mangan (Mn) untuk melawan pengaruh yang merugikan. Penambahan S dalam jumlah dari 0,10% sampai 0,30% akan cenderung memperbaiki machinability dari baja, yang disebut sebagai “resulfurized” atau “freemachining”. Pada free cutting steel, umumnya ditambahkan S sampai 0.35% untuk meningkatkan machinability nya.
Meskipun pengaruh S terhadap baja pada umumnya buruk, namun kandungan kurang dari 0,05% masih dapat ditoleransi. Pengaruh2 tersebut secara umum adalah sbb:
a. S membentuk sulfida yang tidak diinginkan serta menyebabkan terjadinya pelemahan granular dan retakan pada baja saat solidifikasi.
b. S menurunkan titik lebur, kekuatan ikatan intergranular dan kohesifitas baja.
c. S berkontribusi terhadap kerapuhan, dan bila ada dalam fase sulfida ia meningkatkan internal stress dalam produk baja.
Semoga membantu.
Pak, saya mau tanya, bagaimana cara menurunkan kadar sulfur yang berlebihan pada cairan besi .? ..trima kasih..
Yth mas Handoko.
Pada proses peleburan dengan tanur induksi umumnya S sudah rendah karena pemilihan bahan baku yang sudah rendah S. Kandungan Mn juga mereduksi S. Bila menggunakan bahan besi kasar dengan S tinggi, perlu dilakukan proses desulfurisasi, biasanya menggunakan bahan berbasis Ca, seperti CaC3 (batu karbit) atau juga menggunakan Mg seperti Mg treatment pada besi cor nodular. Untuk peleburan dengan tanur kupola, gunakan lining basa dan CaC3 bersama dengan batu kapur.
Semoga membantu.
pak saya mau tanya pada temperatur berapa belerang bisa efektive menurunkan unsur cupper
Yth mas Muklas.
Belerang (S) berasal dai asam sulfat (H2SO4) akan membentuk senyawa dengan tembaga (Cu) menghasilkan CuSO4.5H2O (cupri sulfat). Biasanya dibuat dengan cara elektrolisis asam sulfat, dengan elektroda tembaga. Semakin tinggi suhu asam sulfat, tentu akan menghasilkan reaksi yang semakin efetive.
Reaksi ini tidak efektive bila diterapkan pada proses peleburan. Sebab S akan segera teroksidasi menjadi gas SO2 yang menguap ke udara sebelum sempat bereaksi dengan Cu.
Semoga membantu.
Slm foundry …
Mo tnya pk..kt trima ms scrap curah untk proses pembuatan baja Tulangan.
Kira2 contoh bahan apa aja yg mengandung S dan P dn bgaimna cara menurunkan jika sdh trlajur diats 0,05 ℅
Trima ksh…
Yth mas Irfan
Semua scrap baja mengandung S dan P. Sulfur bisa diatasi oleh kandungan Mn pada baja tulangan Anda. Phosphor sulit diatasi bila sudah terlanjur tinggi, Maka yang dilakukan adalah mencegahnya yaitu dengan memilih bahan scrap yang tidak terlalu tipis, mengingat P biasanya tinggi pada bahan yang tipis.
Untuk mengetahui seberapa tinggi kandungan suantu bahan scrap, tentu Anda harus mengujinya di lab spektrometri, kemudian Anda dapat mengklasifikasikannya sesuai kebutuhan Anda.
Semoga membantu.
mau tanya pak . apa penyebab shringkage pada ferro castng.
Yth mas Rudy.
Pada saat logam cair didinginkan hingga membeku dan mencapai suhu kamar akan terjadi 3 tipe susut;
a. Susut cair, yaitu susut yang terjadi sejak suhu cair actual hingga mencapai suhu liquidus logam (TL). Susut ini hanya mengurangi volume logam kondisi cair.
b. Susut kristalisasi, yaitu susut yang terjadi pada saat logam mulai mengalami pembekuan (TL) yang bertahap mulai dari daerah dengan enerji terendah menuju kedaerah dengan enerji tertinggi, hingga mencapai suhu titik beku (TS). Susut inilah yang kemudian menyisakan rongga yang disebut shrinkage.
c. Susut padat, yaitu susut yang terjadi pada saat penurunan suhu dari suhu titik beku (TS) sampai dengan suhu kamar. Susut ini mengurangi volume benda sekaligus dimensi2nya.
Semoga membantu.
terima kasih BPK R.widodo atas pemberitahuannya
selamat siang pak widodo..ijin bertanya: jika kandungan besi cor tidak memakai timah apa penyebabnya dan apa pengganti timah dan juga apa unsur timah didalam pembuatan FC
Yth mbak Indah
Timah (Sn) memiliki efek sebagai Carbide promoter. Jadi pada besi cor, yang memiliki struktur perlite dan grafit, ia berguna sebagai perlite builder. Efek samping dari Sn adalah destroy nodular grafite. Jadi dia tidak dapat diterapkan pada besi cor nodular.
Masalah lain adalah, melting pointnya yang rendah mengakibatkan losses yang tinggi, serta kecenderungan gas defect yang naik. Unsur lain sebagai perlite builder yang lebih aman terhadap grafit adalah Cu. Ia digunakan pada peleburan besi cor lamelar maupun nodular.
Semoga membantu.
Mau nanya nih pak, bilamana unsurt belerangnya berlebihan apa effect yg akan terjadi ya pak? Atau menjadikan materialnya bagaimana ya pak?
Yth mas Harits.
Klo menyimak artikel diatas, secara teknis efek terhadap produk adalah perapuhan dan korosi intergranular.
Semoga membantu.
kalau casting terjadi seperti akibat apa pak.sering terjadi ditempat kami.terimakasih
selamat pagi.pak mau tanya kalau pembuatan FCD terlalu rendah akaibat apa ya.terima kasih
Yth mas Rudy.
Unsur S belerang tidak dikehendaki pada FCD, jadi S harus serendah mungkin untuk menghasilkan pembulatan grafit yang baik.
Semoga membantu.
Terina kasih
selamat sore… saya mau tanya jika kekerasan atau hardnes mould untuk mesin disa matic berapa ya max dan min